ULIPRISTAL ACETATO – ELLAONE_ESMYA
Pagina pubblicata il 5/04/2012 – ultimo aggiornamento: 22/12/2019
Nome del farmaco:
EllaOne 30 mg compresse
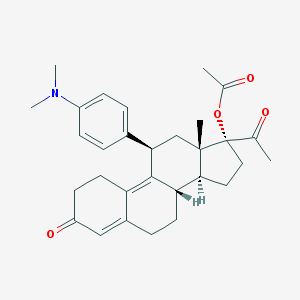
Ulipristal Acetato: formula di struttura (fonte: PubChem)
Nome IUPAC: [(8S,11R,13S,14S,17R)-17-acetyl-11-[4-(dimethylamino)phenyl]-13-methyl-3-oxo-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-17-yl] acetate
SCHEDA TECNICA ELLAONE (RCP) ==> da QUI (fonte: EMA 22/12/2019
sintesi di una relazione di valutazione pubblica europea (EPAR) per ellaOne destinata al pubblico
INDICAZIONI (EllaOne):
“Contraccettivo d’emergenza da assumersi entro 120 ore (5 giorni) da un rapporto sessuale non protetto o dal fallimento di altro metodo contraccettivo.”
CONTROINDICAZIONI
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1 dell’RCP.
AVVERTENZE SPECIALI E PRECAUZIONI D’IMPIEGO
MECCANISMO D’AZIONE
Ulipristal acetato è un modulatore selettivo sintetico del recettore del progesterone, attivo per via orale, che agisce legandosi con grande affinità al recettore umano del progesterone. Il meccanismo d’azione primario consiste nell’inibire o ritardare l’ovulazione. Dati farmacodinamici mostrano che, anche se assunto immediatamente prima del momento in cui è prevista l’ovulazione, ulipristal acetato in alcune donne, è in grado di posticipare la rottura follicolare. (fonte: RCP)
Nota Informativa Importante AIFA su ellaOne (ulipristal acetato) del 16/03/2018
AIFA ricorda agli operatori sanitari e alle utilizzatrici di segnalare attraverso l’apposito “Registro delle Gravidanze” (www.hra-pregnancy-registry.com) l’eventuale inizio di una gravidanza se questa insorge dopo l’uso del contraccettivo di emergenza ellaOne
“... Fino ad oggi, i dati raccolti attraverso questo registro delle gravidanze, insieme ai dati di vigilanza postmarketing, hanno consentito di registrare 1119 casi di gravidanze esposte ad ellaOne®(Period Safety Update Report n. 11 – Luglio 2017). ...”
Fonte: AIFA
CON LA DETERMINA 21 APRILE 2015 PUBBLICATA SULLA GAZZETTA UFICIALE N. 105 DEL 08/05/2015 E’ STATA MODIFICATA LA CLASSIFICAZIONE AI FINI DELLA FORNITURA DEL FARMACO ELLAONE CHE ATTUALMENTE E’:
- per le pazienti di età pari o superiore a 18 anni:
- medicinale non soggetto a prescrizione medica, ma non da banco (SOP).
- per le pazienti di età inferiore a 18 anni:
- medicinale soggetto a prescrizione medica da rinnovare volta per volta (RNR)».
Documento di indirizzo redatto dalla Società italiana della contraccezione (Sic) e dalla Società medica italiana della contraccezione (Smic), con il supporto della Società italiana di ginecologia e ostetrici ==> da QUI
ARTICOLO SUL FARMACO ELLAONE IN QUESTO BLOG
Nome del farmaco e formulazioni:
Esmya 5 mg compresse
SCHEDA TECNICA ESMYA(RCP Esmya) ==> da QUI (Fonte: EMA – 13/01/2018)
riassunto della relazione pubblica europea di valutazione (EPAR) destinata al pubblico per Esmya
Il PRAC raccomanda la revoca dell’autorizzazione all’immissione in commercio di ulipristal acetato per il trattamento dei sintomi dei fibromi uterini (04/09/2020
“Una revisione del comitato per la sicurezza dell’EMA (PRAC) ha confermato che ulipristal acetato da 5 mg (Esmya e medicinali generici), utilizzato per il trattamento dei sintomi dei fibromi uterini, può causare danni al fegato, compresa la necessità di trapianto di fegato. Pertanto, il PRAC ha raccomandato la revoca delle autorizzazioni all’immissione in commercio di questi medicinali. …
…
Ulipristal acetato è anche autorizzato come medicinale monodose per la contraccezione d’emergenza. Questa raccomandazione non influisce sui medicinali contenenti ulipristal acetato a dose singola (ellaOne e altri nomi commerciali) utilizzati come contraccettivi di emergenza e non vi è alcuna preoccupazione per il danno epatico con questi medicinali. ...”
Link alla pagina del sito dell’AIFA con la notizia
Comunicazione EMA sulla sicurezza del farmaco Esmya (13/03/2020)
Il Comitato per la Valutazione dei Rischi per la Farmacovigilanza dell’EMA (PRAC) ha raccomandato alle pazienti di interrompere l’assunzione di ulipristal acetato 5 mg (Esmya e medicinali equivalenti) per i fibromi uterini mentre la revisione di sicurezza è in corso sul rischio di danno epatico
” … L’EMA ha avviato la revisione su richiesta della Commissione Europea, in seguito ad un recente caso di danno epatico, che ha portato al trapianto del fegato in una paziente che assumeva il farmaco.
Una revisione dell’EMA del 2018 ha concluso che esiste un rischio di danno epatico raro ma grave con i medicinali a base di ulipristal acetato quando esso è usato per il trattamento dei fibromi uterini, e sono state implementate delle misure per minimizzare il rischio.
Tuttavia, poiché il nuovo caso di grave danno epatico si è verificato nonostante l’implementazione di queste misure, l’EMA ha avviato una nuova revisione. …”
La comunicazione EMA sulla sicurezza del farmaco EMYA del 13/03/2020 in PDF
Comunicazione EMA sulla sicurezza del farmaco Esmya (01/06/2018)
Il Comitato per i medicinali per uso umano (CHMP) dell’EMA, l’Agenzia Europea per i Medicinali, ha concluso la valutazione sul rischio di insorgenza di gravi danni epatici con Esmya (ulipristal acetato) e ha raccomandato che diverse misure debbano essere messe in atto per minimizzarlo.
L’implementazione di queste misure comporta la possibilità di ricominciare il trattamento con Esmya.
La Comunicazione EMA sulla sicurezza del farmaco Esmya del 01/06/2018 in PDF
Comunicazione EMA sulla sicurezza del farmaco Esmya (09/02/2018)
Il Comitato di Valutazione dei Rischi per la Farmacovigilanza (PRAC) dell’EMA sta attualmente rivedendo i benefici e i rischi del medicinale Esmya, in seguito alla presenza di segnalazioni di grave danno al fegato , tra cui insufficienza epatica che ha portato al trapianto di fegato.
Come misura temporanea, mentre la revisione è in corso, il PRAC raccomanda il monitoraggio regolare della funzionalità del fegato per le donne che assumono Esmya per fibromi uterini.
Tutte le donne che assumono Esmya devono sottoporsi ad esami della funzionalità epatica almeno una volta al mese durante il trattamento. Se i valori risultano non nella norma (livelli degli enzimi epatici superiori a 2 volte rispetto alla norma), il medico deve interrompere il trattamento e monitorare attentamente la paziente.
Gli esami di funzionalità epatica devono essere ripetuti 2-4 settimane dopo l’interruzione del trattamento.
Per il momento nessuna nuova paziente deve iniziare il trattamento con questo medicinale.
La Comunicazione EMA sulla sicurezza del farmaco Esmya del 09/02/2018 in PDF
(fonte: AIFA)
INDICAZIONI ESMYA:
Ulipristal acetato (Esmya) è indicato nel trattamento pre-operatorio di sintomi, da moderati a gravi, di fibromi uterini in donne adulte in età riproduttiva.
Ulipristal acetato (Esmya) è indicato nel trattamento intermittente dei sintomi da moderati a gravi di fibromi uterini in donne adulte in età riproduttiva.
CONTROINDICAZIONI ESMYA
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1 dell’RCP.
Gravidanza e allattamento.
Sanguinamento vaginale di eziologia ignota o per motivi diversi dal fibroma uterino.
Carcinoma uterino, della cervice, ovarico o mammario.
PROPRIETA’ FARMACODINAMICHE
Ulipristal acetato è un modulatore selettivo sintetico del recettore del progesterone, attivo per via orale, caratterizzato da un effetto antagonistico parziale tessuto-specifico nei confronti del progesterone.
Endometrio
Ulipristal acetato esercita un effetto diretto sull’endometrio. Se la somministrazione giornaliera di una dose da 5 mg ha inizio durante un ciclo mestruale, la maggior parte dei soggetti (comprese le pazienti con mioma) completerà la prima mestruazione ma non avrà la mestruazione successiva fino al termine del trattamento. Una volta interrotto il trattamento con ulipristal acetato, i cicli mestruali riprendono generalmente entro 4 settimane.
L’azione diretta sull’endometrio provoca alterazioni dell’istologia specifiche di questa categoria di farmaci e definite PAEC. Tipicamente, l’aspetto istologico è un epitelio inattivo e debolmente proliferante associato ad asimmetria della crescita stromale ed epiteliale che produce ghiandole prominenti con dilatazione cistica ed effetti epiteliali combinati estrogenici (mitotici) e progestinici (secretivi). Questo modello è stato osservato nel 60% circa delle pazienti trattate con ulipristal acetato per 3 mesi. Tali alterazioni sono reversibili dopo la cessazione del trattamento. Tali alterazioni non devono essere confuse con iperplasia endometriale.
Circa il 5% delle pazienti in età riproduttiva con mestruazioni abbondanti presentano uno spessore endometriale superiore a 16 mm. In circa il 10-15% delle pazienti trattate con ulipristal acetato, l’endometrio può ispessirsi (> 16 mm) durante il primo ciclo di trattamento di 3 mesi. In caso di cicli di trattamento ripetuti, la frequenza dell’ispessimento endometriale è risultata minore (il 4,9% delle pazienti dopo il secondo ciclo di trattamento e il 3,5% dopo il quarto ciclo di trattamento). L’ispessimento scompare dopo l’interruzione del trattamento e la ripresa delle mestruazioni. Nel caso in cui l’ispessimento endometriale persista dopo la ripresa delle mestruazioni durante il periodo di sospensione del trattamento oppure oltre i 3 mesi che seguono la fine dei cicli di trattamento, può essere necessario eseguire ulteriori indagini secondo la pratica clinica abituale per escludere altre patologie sottostanti.
Fibromi
Ulipristal acetato esercita un’azione diretta sui fibromi riducendone le dimensioni mediante inibizione della proliferazione cellulare e induzione di apoptosi.
Ghiandola pituitaria
Una dose giornaliera di ulipristal acetato 5 mg inibisce l’ovulazione nella maggioranza delle pazienti, come indicato da livelli di progesterone costanti intorno a 0,3 ng/mL.
Una dose giornaliera di ulipristal acetato 5 mg sopprime parzialmente i livelli di FSH, ma i livelli di estradiolo nel siero sono mantenuti nell’intervallo medio-follicolare nella maggioranza delle pazienti e sono simili ai livelli riscontrati nelle pazienti che ricevevano placebo.
Ulipristal acetato non influisce sui livelli di TSH, ACTH o prolattina nel siero.
CONFEZIONI E PRESCRIVIBILITA’
- Esmya 5 mg – compressa – uso orale – blister (ALU/PVC/PE/PVDC) – 28 compresse
- Medicinale soggetto a prescrizione medica limitativa, da rinnovare volta per volta, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti – ginecologo (RNRL)
- Classe di rimborsabilità: A Nota 51
- Prezzo ex factory (IVA esclusa): € 149,10
- Prezzo al pubblico (IVA inclusa): € 246,08
Ulipristil acetato su PubMed ==> da QUI
Ulipristal acetato sul sito della FDA ==> da QUI
Ulipristal acetato sul sito della Cochrane ==> fa QUI
Ulipristal Acetato su Google Scholar (ricerca globale) ==> da QUI
Ulipristal Acetato su Google Scholar (Ricerca in lingua italiana) ==> da QUI